- +1
自然:輝瑞新冠疫苗1/2期臨床試驗產生強有力免疫應答
當地時間8月12日,頂級學術期刊《自然》(Nature)在線發表的一項1/2期新冠疫苗臨床試驗的中期報告顯示,候選新冠RNA疫苗BNT162b1能在18歲至55歲健康成年人中誘導產生強有力的免疫應答。

該項研究題為,“Phase 1/2 study of COVID-19 RNA vaccine BNT162b1 in adults”,由來自美國紐約大學朗格尼疫苗中心、紐約大學格羅斯曼醫學院、馬里蘭大學醫學院疫苗開發和全球健康中心、輝瑞公司(Pfizer Inc)、辛辛那提兒童醫院等的研究團隊完成,通訊作者為制藥巨頭輝瑞公司的Judith Absalon博士。
RNA疫苗平臺利用信使RNA誘導免疫應答,這種疫苗的安全性被普遍認可,加快了針對SARS-CoV-2的疫苗開發速度。BNT162b1通過肌內注射,能編碼SARS-CoV-2受體結合結構域的一種抗原。研究人員正在對多個同類的候選RNA疫苗進行平行研究,以便選出合適的候選疫苗進入接下來的安全性和效力試驗。
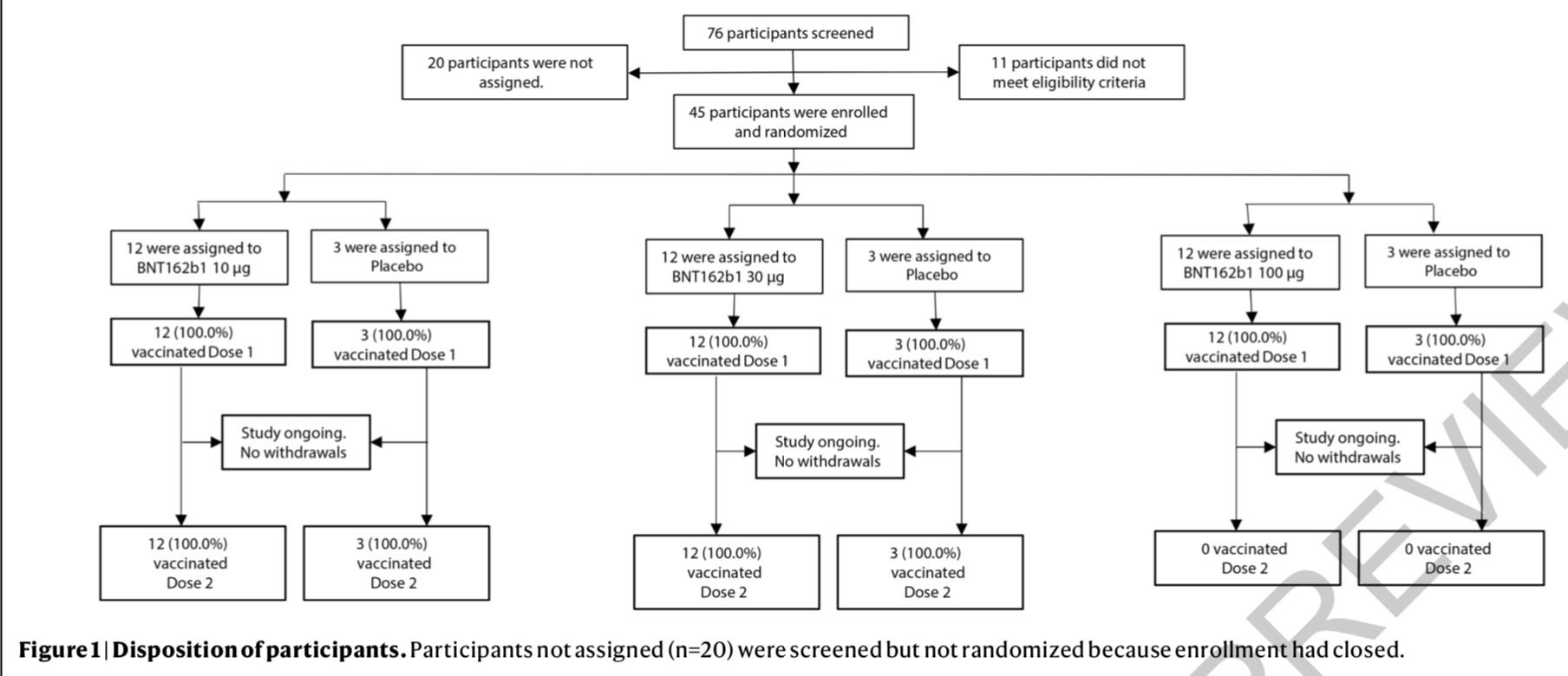
Absalon及其同事報道了尚在進行的BNT162b1的1/2期臨床研究中期數據。45名年齡在18歲至55歲的健康成年人(23名男性和22名未妊娠女性,37人為白人)隨機注射10微克(μg)、30μg或100μg的BNT162b1,或是安慰劑。10μg組和30μg組的受試者在第21天還注射了第二劑。
研究團隊發現,BNT162b1普遍耐受良好,但部分受試者在接種后7天內出現了輕到中度的不良反應,包括注射部位酸痛、疲乏、頭痛、發熱、睡眠障礙,這些不良反應與劑量大小成正比。
研究顯示,該疫苗能在受試者中誘導強效免疫應答,免疫應答水平隨注射劑量的提高和第二劑注射而提高。所有劑量單次注射后的21天都出現了SARS-CoV-2抗體,注射第二劑10μg或30μg的7天后,SARS-CoV-2中和抗體顯著增加。30μg組的免疫應答比10μg組要強很多;但30μg組和100μg組的免疫應答在一次注射后沒有顯著差異。由于100μg組受試者的不良反應較大,他們沒有接受第二劑注射。
研究還顯示,受試者的中和抗體水平是SARS-CoV-2感染康復患者的1.9倍到4.6倍。
研究還強調,雖然這類比較可以作為疫苗誘導免疫應答和疫苗提供保護的評價基準,仍需開展3期試驗來確定BNT162b1的效力。目前,這項研究正在招募65歲至85歲的成年人,后期將優先招募更能代表多樣性的人群。
值得一提的是,在全球疫情肆虐的大背景下,大型制藥公司主導的新冠疫苗未上市就備受期待。此前的7月20日說,英國政府宣布已經與輝瑞公司等制藥企業簽署協議,確保一旦新冠疫苗研制成功,英國獲得9000萬支疫苗的優先采購權。 隨后的7月22日,美國衛生部長亞歷克斯·阿扎爾宣布,已與輝瑞公司簽訂合同,一旦研發的新冠病毒疫苗安全有效,美國政府就向該公司支付19.5億美元,該公司則在12月交付1億劑疫苗。
7月31日,日本政府也與輝瑞達成基本協議,若新冠疫苗開發成功,到明年6月底前輝瑞將提供6000萬人份疫苗,這是日本政府首次為確保新冠疫苗與制藥公司達成協議。





- 報料熱線: 021-962866
- 報料郵箱: news@thepaper.cn
互聯網新聞信息服務許可證:31120170006
增值電信業務經營許可證:滬B2-2017116
? 2014-2025 上海東方報業有限公司




