- +1
賽迪顧問︱收益過低,企業(yè)抗病毒藥物研發(fā)動(dòng)力不足
抗新型冠狀病毒藥品是指能抑制新型冠狀病毒繁殖或殺滅冠狀病毒藥品的統(tǒng)稱,這類藥品可以直接抑制或殺滅病毒、干擾病毒吸附、阻止病毒穿入細(xì)胞、抑制病毒生物合成、抑制病毒釋放或增強(qiáng)宿主抗病毒能力等。
截至3月24日,針對(duì)本次新型冠狀病毒引發(fā)的肺炎疫情,中國(guó)臨床試驗(yàn)注冊(cè)中心已登記了449項(xiàng)新型冠狀病毒研究,其中,獲批準(zhǔn)的藥物臨床試驗(yàn)共120項(xiàng)。試驗(yàn)涉及洛匹那韋、利托那韋、雙黃連口服液、血必凈注射液、連花清瘟膠囊/顆粒等藥物。
一、國(guó)內(nèi)產(chǎn)業(yè)鏈總體布局情況
抗新型冠狀病毒藥品產(chǎn)業(yè)鏈包括上游的抗新型冠狀病毒藥品原料藥與制藥設(shè)備、中游的藥品研發(fā)與生產(chǎn)、下游的藥品流通與銷售等環(huán)節(jié)相關(guān)產(chǎn)業(yè)在內(nèi)的統(tǒng)稱。其中最核心的是中游的藥品研發(fā)與生產(chǎn),主要分為化學(xué)藥、生物藥和中藥三大細(xì)分領(lǐng)域。
圖1 中國(guó)抗新型冠狀病毒藥物產(chǎn)業(yè)鏈
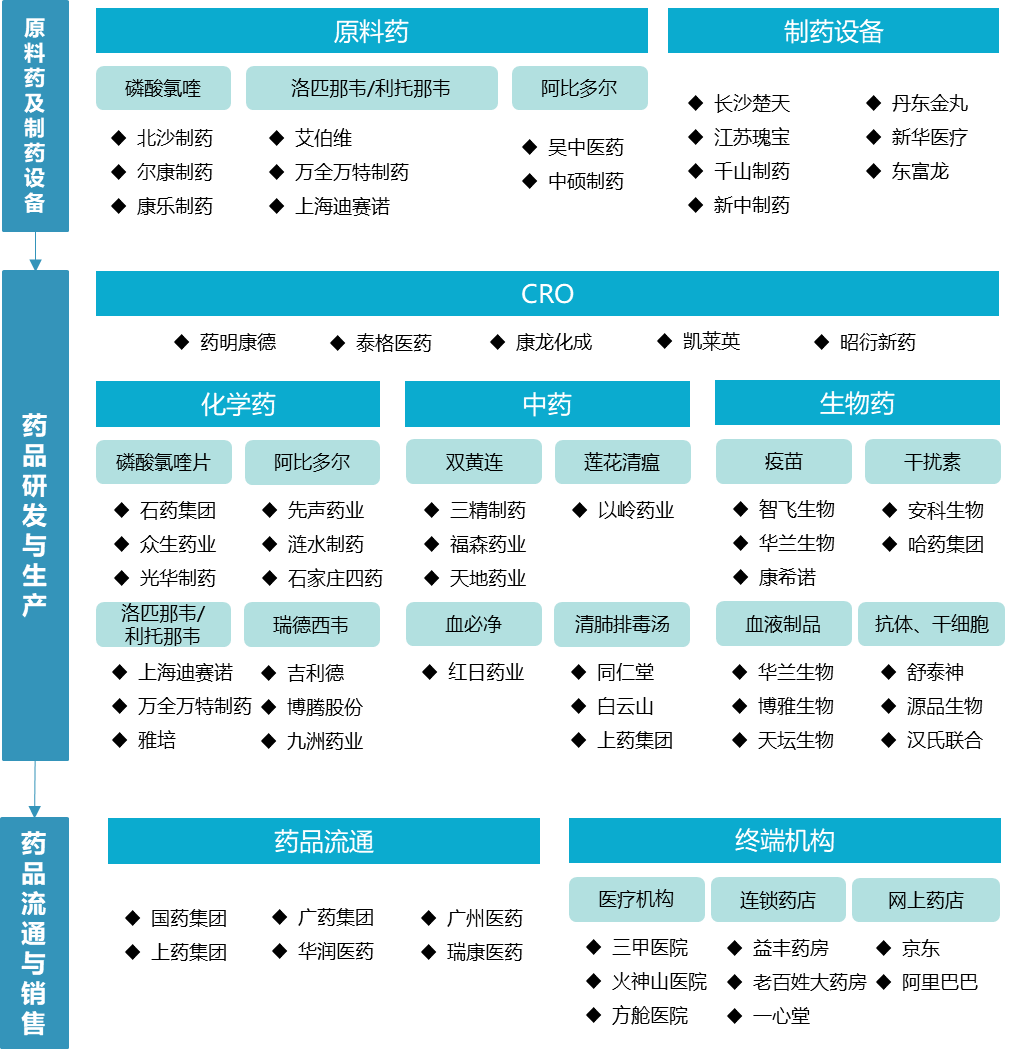
二、重要環(huán)節(jié)進(jìn)展情況
1、大宗原料藥較有優(yōu)勢(shì),抗新型冠狀病毒原料藥部分依賴進(jìn)口
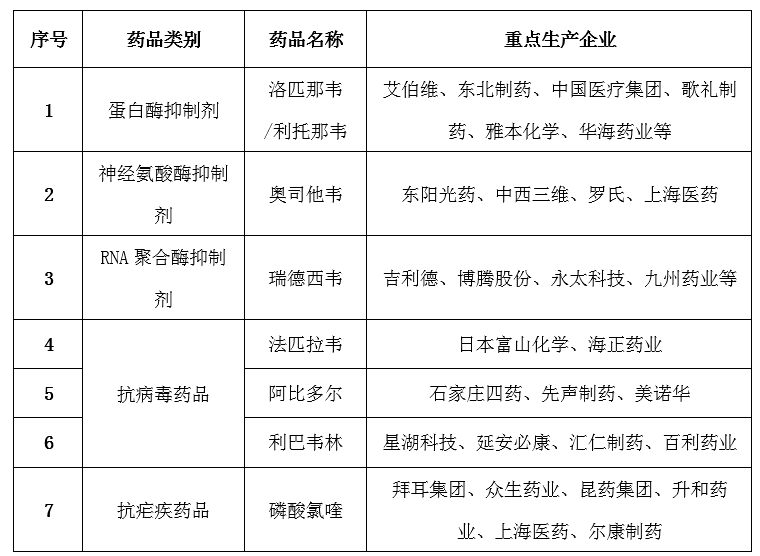
我國(guó)是全球最大的抗病毒藥品原料藥生產(chǎn)和出口國(guó),尤其在大宗原料藥領(lǐng)域占有絕對(duì)優(yōu)勢(shì),重點(diǎn)產(chǎn)品包括抗生素、微生物、解熱鎮(zhèn)痛類等原料藥。從產(chǎn)業(yè)布局看,亞洲、歐洲和北美洲為我國(guó)三大出口市場(chǎng),印度、美國(guó)和日本為我國(guó)原料藥前三大出口國(guó)家。在抗新型冠狀病毒原料藥方面,磷酸氯喹、利托那韋、阿比多爾等為主要原料藥。其中,洛匹那韋和瑞德西韋國(guó)內(nèi)暫無(wú)生產(chǎn)廠家。
圖2 我國(guó)原料藥(含醫(yī)藥中間體)出口量(萬(wàn)噸)
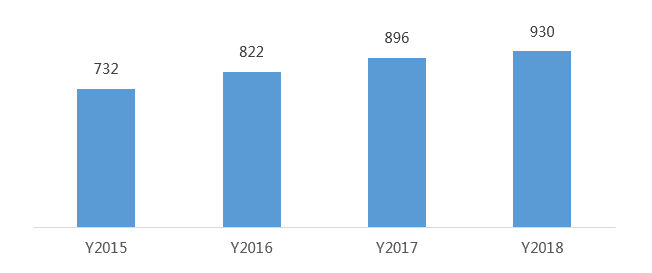
圖3 我國(guó)抗新型冠狀病毒原料藥生產(chǎn)企業(yè)

2、CRO產(chǎn)業(yè)規(guī)模高速增長(zhǎng),企業(yè)積極進(jìn)行抗新型冠狀病毒產(chǎn)品研發(fā)
2019年我國(guó)CRO(合同研究組織)產(chǎn)業(yè)規(guī)模536億元,同比增長(zhǎng)31.1%。我國(guó)CRO起步較晚,已涌現(xiàn)出一批優(yōu)秀的CRO企業(yè)
圖4 中國(guó)CRO產(chǎn)業(yè)規(guī)模及增長(zhǎng)率
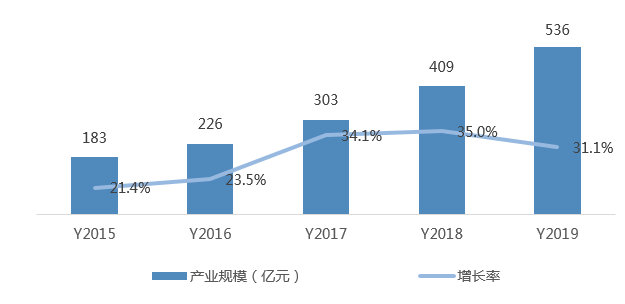
表1 部分CRO企業(yè)開展的抗新型冠狀病毒相關(guān)研究

3、化學(xué)藥產(chǎn)業(yè)規(guī)模穩(wěn)定增長(zhǎng),抗新型冠狀病毒藥物以化學(xué)藥為主
抗病毒藥物以化藥為主,“老藥新用”是治療新冠病毒的重要近期策略。目前,超過50種已有MERS或SARS抑制劑可以被用于篩選治療新冠病毒的候選藥物。目前較常用的藥物主要以洛匹那韋/利托那韋、奧司他韋、瑞德西韋、法匹拉韋等國(guó)外藥企主導(dǎo)的化學(xué)藥為主。其中,瑞德西韋(Remdesivir)是美國(guó)吉利德公司針對(duì)埃博拉病毒開發(fā),目前正在開展三期臨床,可作為“同情用藥” 在臨床使用。法匹拉韋(Favipiravir)是日本富山化學(xué)公司開發(fā)的廣譜抗RNA病毒藥物,在臨床試驗(yàn)中顯示了較明顯的療效,海正藥業(yè)購(gòu)買了該產(chǎn)品國(guó)內(nèi)授權(quán),并將該產(chǎn)品以“流感適應(yīng)癥”率先獲批上市,該藥物亦可作為新冠肺炎的臨床試驗(yàn)用藥。
圖5 中國(guó)化學(xué)藥產(chǎn)業(yè)規(guī)模及增長(zhǎng)率
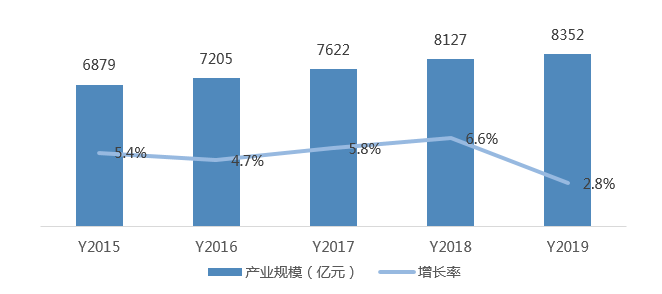
表2 抗新型冠狀病毒化學(xué)藥生產(chǎn)企業(yè)
4、生物藥產(chǎn)業(yè)規(guī)模高速增長(zhǎng),生物藥為抗新型冠狀病毒新療法
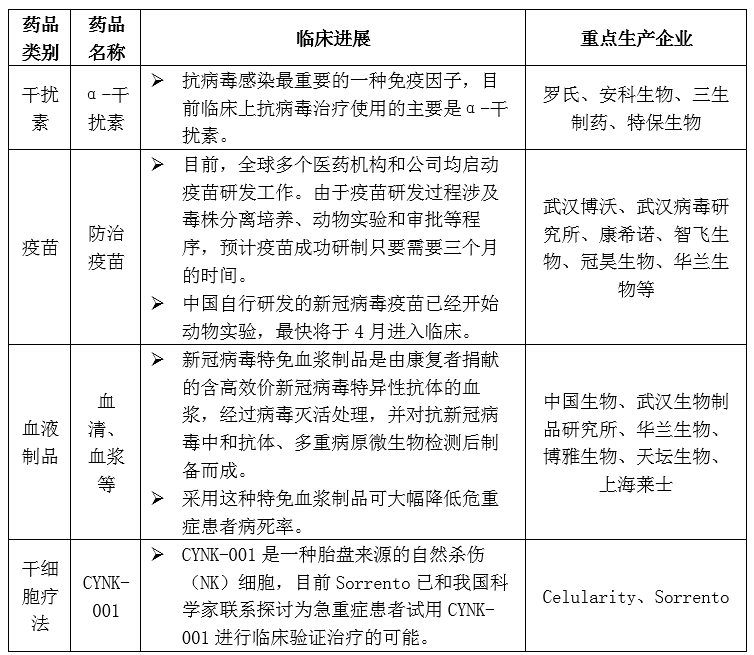
在抗新型冠狀病毒原料藥方面,干擾素臨床應(yīng)用最多,疫苗和干細(xì)胞產(chǎn)品正在研發(fā)中。干擾素是抗病毒感染最重要的一種免疫因子,目前臨床上抗病毒治療使用的主要是α-干擾素。
圖7 中國(guó)生物藥產(chǎn)業(yè)規(guī)模及增長(zhǎng)率
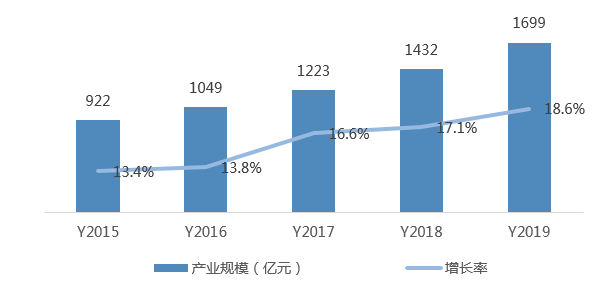
表4 抗新型冠狀病毒生物藥生產(chǎn)企業(yè)
三、產(chǎn)業(yè)鏈關(guān)鍵短板分析
1、企業(yè)創(chuàng)新動(dòng)力不足
近些年,我國(guó)創(chuàng)新藥臨床申請(qǐng)主要集中在抗腫瘤領(lǐng)域,抗病毒藥創(chuàng)新普遍不足,具體到烈性傳染病抗病毒藥的研發(fā)創(chuàng)新更少。2009-2019年,我國(guó)藥監(jiān)局批準(zhǔn)的抗病毒新藥大約20多個(gè),大部分是針對(duì)艾滋病、乙肝和丙肝病毒的慢病領(lǐng)域,主要原因是烈性傳染病抗病毒藥物研發(fā)投入高且存在高風(fēng)險(xiǎn),一款新藥的研發(fā)試驗(yàn)?zāi)酥翆徟鲜校?jīng)歷十幾年的漫長(zhǎng)投入和時(shí)間。烈性傳染病新型病毒具有高傳染性、高暴發(fā)性、短周期等特點(diǎn),等到研發(fā)一款有效藥出來,很可能病毒疫情已經(jīng)結(jié)束,即使等到下一次的疫情暴發(fā),又有可能出現(xiàn)不同的病毒。
另外,一旦發(fā)生病毒暴發(fā),如走政府采購(gòu),一般研發(fā)回報(bào)相對(duì)較低。因此高研發(fā)費(fèi)用和不可控的市場(chǎng)前景,一般創(chuàng)新藥企很難長(zhǎng)期堅(jiān)持做烈性傳染病抗病毒藥。這也是為何2003年“非典”的幾個(gè)抗病毒研發(fā)項(xiàng)目在疫情結(jié)束后,由于缺乏病人和研發(fā)經(jīng)費(fèi)支持,藥物研發(fā)停止。
2、政府亟待完善可持續(xù)的支持模式
與美國(guó)相比,在烈性抗病毒藥研發(fā)創(chuàng)新方面,我國(guó)缺乏有效、可持續(xù)性的政府支持與鼓勵(lì)制度,僅有重大新藥創(chuàng)制等一次性的財(cái)政專項(xiàng),未建立可持續(xù)性的多方合作研發(fā)機(jī)制。例如,美國(guó)國(guó)際開發(fā)署(USAID)通過與高校研究單位建立合作伙伴關(guān)系,資助企業(yè)開展圍繞公共衛(wèi)生領(lǐng)域里的新技術(shù)和新藥的研發(fā)。目前,USAID已經(jīng)儲(chǔ)備有150個(gè)創(chuàng)新項(xiàng)目,也包括開發(fā)抗埃博拉病毒的抗病毒藥物。2018年,美國(guó)食品藥品監(jiān)督管理局(FDA)批準(zhǔn)了首款天花特效藥物TPOXX,該藥物后期研發(fā)由美國(guó)政府生物醫(yī)學(xué)高級(jí)研究與發(fā)展局資助,并在獲批上市后購(gòu)買200萬(wàn)份作為國(guó)家戰(zhàn)略儲(chǔ)備。
3、基礎(chǔ)研究配套不足
與美國(guó)相比,我國(guó)高級(jí)別生物安全實(shí)驗(yàn)室數(shù)量少。新發(fā)病原體的暴發(fā)在世界范圍內(nèi)越來越頻繁, 從2003年的SARS-CoV、2009年的H1N1甲型流感病毒、2012年的MERS-CoV、2015年的埃博拉病毒、2016年的寨卡病毒、2017年的H5N7禽流感病毒到這次的新型冠狀病毒, 除寨卡病毒外所有的病毒都是三級(jí)生物安全實(shí)驗(yàn)室(BSL-3)級(jí)別的病原體, 所有的相關(guān)研究都需要在BSL-3實(shí)驗(yàn)室及以上進(jìn)行。
而截至目前,我國(guó)共有BSL-3實(shí)驗(yàn)室43家(包括獸醫(yī)農(nóng)業(yè)領(lǐng)域7家), 四級(jí)生物安全實(shí)驗(yàn)室(BSL-4)實(shí)驗(yàn)室1家。美國(guó)具備BSL-3資質(zhì)的實(shí)驗(yàn)室已達(dá)1000多家,可運(yùn)營(yíng)或計(jì)劃中的BSL-4實(shí)驗(yàn)室13家。在美國(guó),所有高水平大學(xué)醫(yī)學(xué)院和醫(yī)院基本都配備BSL-3實(shí)驗(yàn)室, 其規(guī)模不一定很大, 但可以滿足相關(guān)學(xué)校和醫(yī)院的研究和檢測(cè)需求,方便快速?gòu)呐R床上分離危險(xiǎn)病原體以及展開后續(xù)基礎(chǔ)研究。
四、發(fā)展建議
1、探索多元化的抗病毒藥物研發(fā)模式
一是鼓勵(lì)龍頭企業(yè)牽頭建立的抗病毒研發(fā)聯(lián)盟。龍頭企業(yè)聯(lián)合高校、公共機(jī)構(gòu)、CRO和基金會(huì)等,通過會(huì)費(fèi)的形式建立共同研發(fā)基金,開展藥物研發(fā)。二是探索政府-民營(yíng)共同研發(fā)投入的 PPP模式。在PPP項(xiàng)目中,政府公共部門主要負(fù)責(zé)研發(fā)方案設(shè)計(jì)、組織病源、初期研發(fā)資金注入,研發(fā)項(xiàng)目成功后,民營(yíng)企業(yè)低價(jià)為政府提供具有專利權(quán)的藥品,同時(shí)可以獲得臨床試驗(yàn)數(shù)據(jù)、產(chǎn)品推廣效應(yīng)和政府相關(guān)試點(diǎn)項(xiàng)目。三是建立新藥預(yù)儲(chǔ)備模式。新冠病毒是新型病毒,對(duì)其臨床和流行性病學(xué)的深入了解和掌握都可以對(duì)今后的藥物研究打下基礎(chǔ)。國(guó)內(nèi)企業(yè)可充分利用“機(jī)會(huì)窗口”做好產(chǎn)品儲(chǔ)備、臨床儲(chǔ)備和研究?jī)?chǔ)備。四是建立國(guó)內(nèi)外企業(yè)間合作模式。通過本土藥企和國(guó)外藥企聯(lián)合攻關(guān),尋找?guī)讉€(gè)靶點(diǎn)合作開發(fā)多種新藥。
2、創(chuàng)新政府支持藥物研發(fā)的方式
一是將加強(qiáng)烈性傳染病抗病毒藥研發(fā)列入國(guó)家戰(zhàn)略規(guī)劃層面。2021年我國(guó)第十四個(gè)五年計(jì)劃和藥品專項(xiàng)計(jì)劃將出臺(tái),建議將加強(qiáng)應(yīng)對(duì)突發(fā)公共衛(wèi)生病毒藥物研發(fā)的建議納入計(jì)劃中。
二是將烈性傳染病抗病毒藥納入各類國(guó)家專項(xiàng)扶持項(xiàng)目重點(diǎn)方向。在國(guó)家重大新藥創(chuàng)制專項(xiàng)、傳染病研發(fā)重大專項(xiàng)等專項(xiàng)中增加烈性傳染病抗病毒藥扶持方向,適當(dāng)增加資金支持力度。
三是探索政府-民營(yíng)共同研發(fā)投入的 PPP模式。PPP項(xiàng)目政府公共部門主要負(fù)責(zé)研發(fā)方案設(shè)計(jì)、組織病源、初期研發(fā)資金注入,研發(fā)項(xiàng)目成功后,民營(yíng)企業(yè)低價(jià)為政府提供具有專利權(quán)的藥品,同時(shí)可以獲得用于產(chǎn)品更新的臨床試驗(yàn)數(shù)據(jù)、產(chǎn)品推廣效應(yīng)和政府相關(guān)試點(diǎn)項(xiàng)目。
3、加強(qiáng)基礎(chǔ)研發(fā)配套設(shè)施建設(shè)
我國(guó)烈性傳染病抗病毒藥物基礎(chǔ)研發(fā)配套短板主要體現(xiàn)在高水平生物安全實(shí)驗(yàn)室數(shù)量較少,下一步,需加強(qiáng)高水平生物安全實(shí)驗(yàn)室建設(shè),建議整體布局、加大投入,分批次建立各類高水平生物安全實(shí)驗(yàn)室。首先,建立重大傳染病國(guó)家實(shí)驗(yàn)室, 并由國(guó)家實(shí)驗(yàn)室管理和實(shí)施“傳染病重大專項(xiàng)科技計(jì)劃”,在各省市建立國(guó)家實(shí)驗(yàn)室分部,全面開展傳染病流行病學(xué)、預(yù)防、藥物和疫苗研發(fā)。其次,在高水平醫(yī)學(xué)院、研究機(jī)構(gòu)布局建立若干BSL-3級(jí)實(shí)驗(yàn)室, 建立有效的管理制度,保證在疫情暴發(fā)時(shí)實(shí)驗(yàn)室可以有效為臨床提供服務(wù)。
(作者孫會(huì)峰系賽迪顧問總裁)





- 澎湃新聞微博
- 澎湃新聞公眾號(hào)

- 澎湃新聞抖音號(hào)
- IP SHANGHAI
- SIXTH TONE
- 報(bào)料熱線: 021-962866
- 報(bào)料郵箱: news@thepaper.cn
滬公網(wǎng)安備31010602000299號(hào)
互聯(lián)網(wǎng)新聞信息服務(wù)許可證:31120170006
增值電信業(yè)務(wù)經(jīng)營(yíng)許可證:滬B2-2017116
? 2014-2025 上海東方報(bào)業(yè)有限公司



