- +1
這款乳腺癌新藥,或使受益人群從20%提高至50%
·Trastuzumab Deruxtecan在2022年5月被中國藥監局納入優先審批行列,距今不到一年就獲批。甚至在藥監局審批前,2022年2月就落戶海南博鰲樂城國際醫療旅游先行區。這次中國獲批的還是HER2陽性乳腺癌,但HER2低表達乳腺癌的上市申請也已被藥監局受理。我們可以看到近年來很多對患者幫助極大的創新藥的軌跡:國內外上市的時間差不斷縮短。此外,國內也有大量的抗體偶聯藥屬于研發狀態,在技術層面的創新也在與國外逐漸同步。
Trastuzumab Deruxtecan(德曲妥珠)。
2月24日,中國國家藥品監督管理局(NMPA)批準了阿斯利康和第一三共聯合開發的抗體偶聯藥物Trastuzumab Deruxtecan(德曲妥珠)在過往治療耐藥的HER2陽性乳腺癌患者中使用。
每年獲批上市的新藥有很多,但Trastuzumab Deruxtecan絕非一個平平無奇的新藥。在2022年6月5日,匯聚全球腫瘤領域精英的美國臨床腫瘤學會年會上,它的一個乳腺癌三期臨床試驗報告獲得全場起立鼓掌的特殊待遇。這可以說是極為罕見的殊榮。
Trastuzumab Deruxtecan憑什么獲得了這種區別對待?這是因為從醫學角度,它重新定義了乳腺癌治療的格局;從藥物研發角度,它代表了抗體偶聯這一整個藥物技術平臺的突破。

2月24日,國家藥品監督局管理局發布的藥品批準證明文件送達信息截圖。
在乳腺癌分類與治療基石上的超越
乳腺癌是女性最常見的惡性腫瘤。據世界衛生組織統計,2020年全球就有230萬女性確診乳腺癌,死亡人數達68.5萬。乳腺癌在中國的發生率、死亡率也一直處于上升狀態。在可預見的將來,乳腺癌都會是中國以及全世界極大的健康負擔。
不過乳腺癌預后也有了長足進展。美國2010年后的數據顯示,相對健康人,乳腺癌患者5年的存活率是90%[3]。能有這么高的存活率,主要貢獻因素有兩個,一是有效的篩查讓更多患者在早期就被確診,二是針對不同類型乳腺癌有了更多有效的治療手段。就后者而言,乳腺癌如今分類與治療上起決定因素的是腫瘤細胞HER2與激素受體(HR)的表達狀況。
如果乳腺癌患者腫瘤有HR表達,往往意味著腫瘤細胞的增殖依賴激素,激素阻斷可作為治療手段。而當乳腺癌腫瘤細胞表達HER2時,則可以利用靶向HER2的抗體藥來殺死腫瘤細胞。第一個HER2抗體藥,也是HER2陽性乳腺癌治療的基石,就是曲妥珠單抗(Trastuzumab)。
曲妥珠單抗在1992年進入人體試驗,到1996年時臨床試驗已擴展到900人,但由于該藥聲名在外,迫于社會壓力,藥企與FDA不得不允許每季度抽簽1000名患者在臨床試驗外獲得該藥物的使用。自1998年被FDA批準后,它對乳腺癌的治療、預后都產生了巨大的影響。如果不考慮治療手段,HER2陽性的乳腺癌相較HER2陰性乳腺癌惡性程度更高,預后也更差。可是曲妥珠單抗上市后,大幅改善了HER2陽性乳腺癌的預后,如今HER2陽性乳腺癌反而成了預后最好的類型。曲妥珠單抗僅原研藥如今已惠及的病人超過230萬,可以說在乳腺癌甚至整個腫瘤治療領域都是具有革命意義的創新。
但只有HER2陽性的病人才能從曲妥珠單抗等HER2靶向藥中獲益,而這只是乳腺癌患者中的一小部分——HER2陽性的乳腺癌患者不到所有病人的20%:
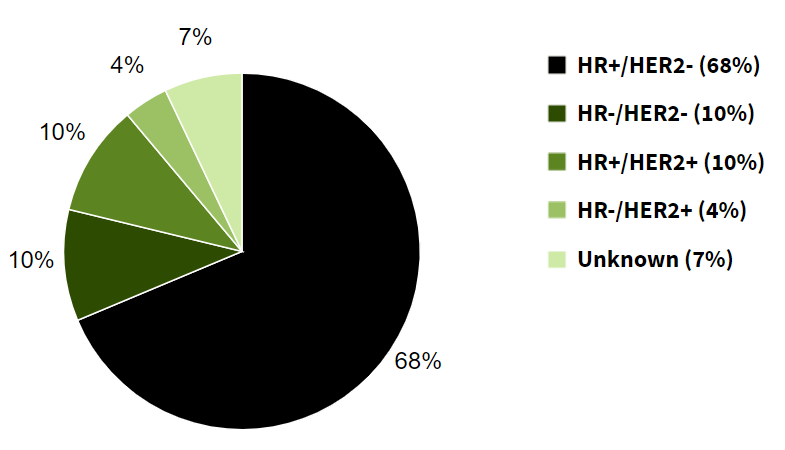
附圖1.乳腺癌患者各分型占比(美國2015-2019數據)
絕大多數患者并沒有機會從HER2靶向藥中獲益。特別是三陰性乳腺癌(HR-/HER2-),很多人可能也聽說過這類乳腺癌是最麻煩的。確實三陰性乳腺癌適用的治療藥物很少,一旦到了遠端轉移階段,5年相對存活率只有12%,遠遠低于HR+/HER2+的46%與HR-/HER2+的38.8%。
但與一般人的印象不同,HER2陰性不是說癌細胞沒有表達HER2,只是說HER2表達的量沒有到一個很高的程度。例如目前使用HER2表達鑒定標準,結合了蛋白質表達與基因水平表達。其中蛋白質表達采用IHC技術,只有在0-3分的打分系統里達到3分,或者是2分同時基因表達陽性,才是HER2陽性,否則一律陰性——包括了很多有HER2表達,只是不那么高的情況。
可能有人會好奇,為何如此苛刻,標準放松點,讓更多病人用上HER2靶向藥不好嗎?確實不好。因為試過了,沒用。這種沒用還不僅是乳腺癌里的問題。聽到HER2,大家第一反應都是乳腺癌,其實HER2在別的腫瘤里也是有表達的,為什么沒怎么聽說呢?因為之前也試過,除了極少數情況外還是沒用,這很可能是由于相較乳腺癌,其它腫瘤的HER2表達即使有也低很多。
明明有HER2表達,而且HER2靶向藥在HER2陽性患者里還有非常好的療效,這讓科學家與藥企們對只能把HER2靶向藥用于HER2陽性患者非常不甘心。曲妥珠單抗面世后,很多制藥公司都在嘗試做一個更好的HER2靶向藥。
有的在做一個更好的HER2單抗藥。曲妥珠單抗是20世紀90年代的產品,那時候制作抗體藥的技術遠不如當下先進。曲妥珠單抗對HER2腫瘤的抗癌作用依賴抗體與HER2結合,刺激免疫細胞殺傷被抗體標識出來的癌細胞也是潛在作用機理之一。因此就有藥企嘗試抗體改造,做一個與HER2結合能力更強,刺激免疫細胞殺傷能力也更強的單抗。
抗體偶聯藥——換一種思路
另一種思路是抗體偶聯藥,在HER2抗體上加一個細胞毒性藥物(如化療藥物),讓細胞毒性藥物助力單抗,成為對HER2表達腫瘤殺傷力更強的藥物,能克服“HER2表達量不夠高”這一攔路虎。
不過以往這些嘗試只在解決曲妥珠單抗的耐藥性上取得了有限的成功。比如在曲妥珠基礎上開發的抗體偶聯藥物Trastuzumab Emtansine,HER2陽性的患者對曲妥珠耐藥后,這個藥還能起效。這類進展對患者來說仍然有積極意義,可是沒有讓更多因HER2表達不夠高而沒法用HER2靶向藥的患者受益。
直到Trastuzumab Deruxtecan這個抗體偶聯藥橫空出世。從名字可知,作為抗體偶聯藥物,Trastuzumab Deruxtecan靶向HER2的抗體部分還是1998年就上市的曲妥珠單抗,在此之上又加上了細胞毒性藥物Deruxtecan。
2019年末,FDA先批準了Trastuzumab Deruxtecan在接受過往HER2靶向治療后耐藥的HER2陽性乳腺癌患者中的使用。在相關的臨床試驗中,受試者至少接受過兩種以及更多HER2靶向治療后發生耐藥。可就在這樣的人群里,Trastuzumab Deruxtecan仍然有很好的療效,總體應答率達到了60.3%。之后在更早期的HER2陽性病人中,Trastuzumab Deruxtecan也展示了比Trastuzumab emtansine更好的療效,成了曲妥珠耐藥后的新標準療法。
在一系列的驚人成功后,越來越多的人開始相信Trastuzumab Deruxtecan不僅是一個加強版曲妥珠單抗,曾經限制HER2靶向藥的種種難題——包括HER2的表達量,或許可以被Trastuzumab Deruxtecan突破。
而在2022年6月5日,一項名為DESTINY-Breast04的臨床試驗結果在美國臨床腫瘤學會年會上公布,在該試驗中,HER2陽性這一HER2靶向藥的限制因素終于被Trastuzumab Deruxtecan徹底擊穿。
DESTINY-Breast04試驗中的受試者都是HER2低表達的轉移期乳腺癌患者。試驗中,采用現今的標準療法化療的患者們,腫瘤無進展生存時間是5個月,而Trastuzumab Deruxtecan組直接延長了快一倍,接近10個月。化療組的總體生存時間是16.8個月,Trastuzumab Deruxtecan組接近兩年。
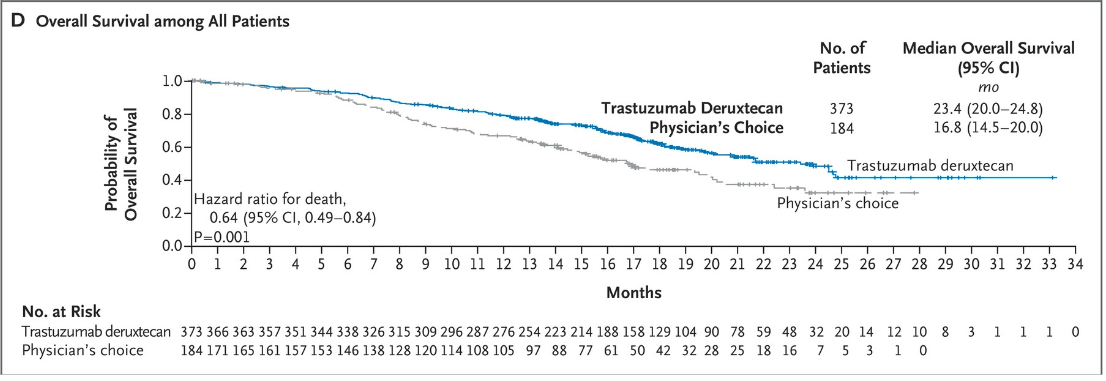
附圖2. Trastuzumab Deruxtecan顯著延遲了HER2地表達患者的生存時間
這些結果意味著采用Trastuzumab Deruxtecan治療,患者疾病惡化的風險下降了近一半,生存時間也大幅延長。
這些HER2低表達患者到底是多低的HER2表達呢?從HER2表達的傳統鑒定中,DESTINY-Breast04試驗中的受試者要么是HER2蛋白表達只有1,或者蛋白表達有2分但基因表達陰性。這些受試者在當下的乳腺癌分類中要么屬于HR陽性HER2陰性,要么屬于三陰性。90%的受試者接受過至少兩線治療,可以說這是一個經歷過多種治療后耐藥,已經沒有什么選擇的患者群體。該結果可以說是出人意料的好。伴隨這一突破性的進展,乳腺癌患者中HER2低表達人群不必再歸于HER2陰性,她們是一個新的獨立分類,Trastuzumab Deruxtecan將成為她們的新標準療法。
HER2低表達的乳腺癌患者有多少呢?80%的乳腺癌患者是HER2陰性,但里面超過60%是有HER2表達。也就是說Trastuzumab Deruxtecan讓HER2靶向藥適用人群從原來的不到20%的HER2陽性人群,一下子增加到了一半以上的乳腺癌患者。
伴隨著Trastuzumab Deruxtecan,我們正在見證乳腺癌,這一女性中發病率最高的癌癥,從分類與治療都將發生翻天覆地的變化。也正是因為這樣重大的意義,當研究人員公布DESTINY-Breast04試驗結果時,即便是見慣了新藥試驗結果公布的美國臨床腫瘤學會年會參與者們也忍不住起立鼓掌致意。
抗體偶聯藥物終獲突破
2022年8月5日,FDA批準了Trastuzumab Deruxtecan在HER2低表達乳腺癌患者中的使用,正式開啟了乳腺癌的分類與治療的變革。可是這一重大革新的背后絕非一帆風順,Trastuzumab Deruxtecan的技術平臺——抗體偶聯藥物,曾經被寄予厚望,又屢次給出讓人失望的結果。可以說,直到Trastuzumab Deruxtecan的出現,抗體偶聯藥物才獲得了真正的“正名”。這也是為什么我們說Trastuzumab Deruxtecan在藥物研發方面,代表了一個技術平臺的突破。
抗體偶聯藥物的概念可以追溯到諾貝爾獎得主Paul Ehrlich在1907提出的“神奇子彈”理論——如果可以將一個毒性物質非常專一地遞送到病灶處,那么將可以清除病灶而不影響身體其它部分。在抗體偶聯藥這個技術平臺里,我們正是希望利用抗體的特異性,例如只與腫瘤細胞結合的抗體,將毒性藥物僅僅送到腫瘤里。
當2001年全球第一個抗體偶聯藥——用于復發型急性髓細胞白血病的Gemtuzumab Ozogamicin被FDA以加速審批上市批準上市后,制藥界對抗體偶聯藥充滿了希望,認為Ehrlich的“神奇子彈”即將通過抗體偶聯藥在癌癥治療里廣泛使用。可接下來迎接抗體偶聯藥的不是對癌癥治療的變革,而是無數次失望。
研究人員很快就發現抗體偶聯藥一點都不像Ehrlich提出的只殺病灶不損傷健康組織的“神奇子彈”。很多抗體偶聯藥的不良反應非常大,甚至都難以在有效劑量與毒性劑量間找到一個治療窗口。Gemtuzumab Ozogamicin這個抗體偶聯藥的老大,因為毒性太大又沒有在后續試驗驗證有效性,還在2010年黯然退市,直到2017年換了一個病人群體重新做試驗,再降低了劑量才得以回歸使用。
為什么會出現如此大的落差?這或許是由于抗體偶聯藥的復雜性被大大低估了。抗體偶聯藥的三個組成:抗體、載藥(如化療藥物)以及連接二者的鏈接,制藥業曾經認為只要把這三個湊到一起,一個毒藥就能被專一地送到腫瘤里,萬事大吉。可現實是很少有只在腫瘤里表達的抗原,因此一個靶向腫瘤的“特異性”抗體多少也會跑到健康組織。鏈接與載藥也不是原先預想的簡單的化學小分子,而是需要仔細考量其穩定性與作用機理。比如鏈接的穩定性問題,是必須在細胞內釋放載藥好,還是不必嚴格在細胞內只要在腫瘤組織內釋放就行,這里面就大有學問。
在抗體偶聯藥因早期的失望陷入低谷,不少藥企紛紛削減投入之際,這一技術平臺卻開始了臥薪嘗膽之旅。揀選抗體與載藥,研發不同鏈接,最終有了以Trastuzumab Deruxtecan為代表的全新一代抗體偶聯藥。
可以與早期的HER2抗體偶聯藥Trastuzumab Emtansine對比,后者平均每個抗體分子上只有3.5個細胞毒性藥物Emtansine,而Trastuzumab Deruxtecan上每個抗體分子連著8個Deruxtecan。連接Trastuzumab與Deruxtecan的鏈接是可剪切的,意味著不用進入腫瘤細胞,鏈接就可以被打破,釋放出來的載藥Deruxtecan殺傷腫瘤細胞的同時還可能起了刺激周圍細胞的作用。Deruxtecan又屬于未在乳腺癌中使用過的化療藥物類型,可能帶來了與以往乳腺癌治療不同的新機理。
正是依賴抗體偶聯藥整個技術平臺過去多年來各種細微創新的積累,才有可能在今天出現Trastuzumab Deruxtecan這樣一個能以一己之力改變最常見、社會影響與負擔最重的癌癥之一的治療方案。
這些累積下來的創新也不會止于HER2低表達乳腺癌這一新劃分出來的腫瘤類型。在DESTINY-Breast04試驗中,HER2表達最低的蛋白評分為1的患者與評分為2的患者療效并無區別。這很可能意味著DESTINY-Breast04試驗還未觸及對Trastuzumab Deruxtecan有反應的HER2表達底線。隨著更多更精細的HER2表達檢測方法投入運用,或許有更多患者能受益于Trastuzumab Deruxtecan。
2022年12月,FDA根據Trastuzumab Deruxtecan在非小細胞肺癌中的臨床試驗結果,又有條件批準了它在HER2變異的非小細胞肺癌患者中的使用。從HER2靶向藥的角度看,Trastuzumab Deruxtecan正在實現只要有HER2表達,不論高低,不論癌癥,都有希望治療的靶點潛力徹底挖掘。而這又是在實現制藥界長期以來對抗體偶聯藥的期望:1+1>2,通過抗體偶聯的平臺,獲得單獨的抗體藥或偶聯的細胞毒性藥,都無法做到的治療效果。
Trastuzumab Deruxtecan的成功,也催生了抗體偶聯藥物的大熱。諸多新一代抗體偶聯藥物進入驗證,乃至進入市場。在一些偶聯藥物里,連接的不再只是化學毒性物質,例如免疫刺激藥物、放療藥物都有嘗試。當然我們很難預測這些藥物是否會成功,可能不少抗體偶聯藥會以失敗告終。但隨著技術的積累,我們或許會看到越來越多的患者獲益于這些潛在的創新藥。而假如若干年后,我們回顧抗體偶聯藥的發展史,Trastuzumab Deruxtecan很可能就是這一技術平臺的轉折點。
多方位創新讓有效藥更快與患者見面
除了技術層面的創新,同樣值得注意的是Trastuzumab Deruxtecan在HER2低表達人群的獲批從藥企遞交申請到FDA批準只用了不到兩周的時間,距離相關試驗結果公布也不過兩個月。這比FDA原定批準時間早了近4個月的提速,背后是藥物監管方面的創新。
FDA對Trastuzumab Deruxtecan的審核采用了實時腫瘤藥物審核(Real-Time Oncology Review ,RTOR)與Orbis計劃。RTOR意味著研發方可以將有效性與安全性數據更早遞交到FDA,讓藥品審核更早開始。Oribis計劃則是讓國家上多個藥品監管部門合作,協同對藥品的審核過程,在很多藥物的臨床試驗進入國際化的當下,加速數據的審核與一個藥品在全球的上市。
各方面的創新意味著我們看到越來越多的創新藥以越來越快的速度上市。曲妥珠單抗最早的臨床試驗是在1992年,即使采用了加速審批,也是在1998年才被FDA批準。而Trastuzumab Deruxtecan第一個臨床試驗是在2015年,2019年就獲得第一個適應癥批準,如今更是以驚人的速度擴展適用人群。
這些創新在中國發生。曲妥珠單抗原研藥2002年批準在中國上市,2017年才進入醫保目錄。而Trastuzumab Deruxtecan在2022年5月就被中國藥監局納入優先審批行列,距今不到一年就獲批。甚至在藥監局審批前,2022年2月就落戶海南博鰲樂城國際醫療旅游先行區。這次中國獲批的還是HER2陽性乳腺癌,但HER2低表達乳腺癌的上市申請也已被藥監局受理。從Trastuzumab Deruxtecan上,我們可以看到近年來很多對患者幫助極大的創新藥的軌跡:國內外上市的時間差不斷縮短。此外,國內也有大量的抗體偶聯藥屬于研發狀態,在技術層面的創新也在與國外逐漸同步。
乳腺癌仍然是全球最常見、致死人數最多的癌癥之一,而癌癥又是全球最致命的疾病類型之一,每6例死亡中就有1例是癌癥導致。但我們仍希望如同Trastuzumab Deruxtecan正在書寫的乳腺癌治療革新,各個層面的創新綜合在一起,可以讓癌癥對我們的威脅,對社會的負擔不斷下降。
(作者周葉斌,系美國阿拉巴馬大學伯明翰分校遺傳性博士,長期從事免疫學研究,目前在藥企從事新藥研發。)
參考資料:
1.https://www.who.int/news-room/fact-sheets/detail/breast-cancer
2.https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8330522/
3.https://www.cancer.org/cancer/breast-cancer/understanding-a-breast-cancer-diagnosis/breast-cancer-survival-rates.html
4.https://www.mdpi.com/2072-6694/12/8/2081
5.https://www.herceptin.com/hcp/indications.html
6.https://seer.cancer.gov/statfacts/html/breast-subtypes.html
7.https://www.fda.gov/news-events/press-announcements/fda-approves-new-treatment-option-patients-her2-positive-breast-cancer-who-have-progressed-available
8.https://www.nejm.org/doi/full/10.1056/NEJMoa2203690?query=featured_home
9.https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-fam-trastuzumab-deruxtecan-nxki-her2-low-breast-cancer
10.https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-gemtuzumab-ozogamicin-cd33-positive-aml
11.https://www.nature.com/articles/s41591-022-01935-8
12.https://www.himd.com/article/r_191_94.html
13.https://www.pharmcube.com/index/news/article/9531
14.https://www.who.int/news-room/fact-sheets/detail/cancer





- 報料熱線: 021-962866
- 報料郵箱: news@thepaper.cn
互聯網新聞信息服務許可證:31120170006
增值電信業務經營許可證:滬B2-2017116
? 2014-2025 上海東方報業有限公司




